C’est le quatrième υvaccin autorisé après ceux de Pfizer/Biotech, Moderna et AstraZénéca.
Le premier vaccin à dose unique.
Ce vaccin s’appuie sur la plateforme technologique adénovirus à l’instar de celui développé par AstraZénéca. Il consiste à intégrer dans son ADN une partie du génome du SARS-CoV-2 codant pour la protéine spike puis à injecter ce virus rendu inoffensif pour induire une réponse immunitaire contre la COVID-19.
Il s’administre en une seule dose et peut se conserver 3 mois à température réfrigérée classique. De plus, il ne nécessite aucune reconstitution et il est prêt à l’emploi. Il sera vendu à prix coûtant (7 €) le plaçant juste derrière le vaccin d’AtraZénéca (2€) et bien en dessous de Pfizer (16€) et Moderna (15€).
Ces avantages sont considérables en période pandémique en permettant notamment une logistique simplifiée en particulier dans les pays à faibles ressources.
Une efficacité satisfaisante.
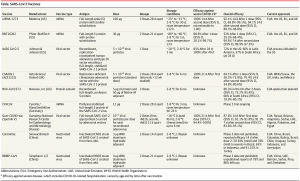
L’autorisation conditionnelle de l’Agence européenne du médicament (Lire) accordée le 11 mars 2020 s’appuie notamment sur l’analyse d’un essai clinique en phase 3 mené sur plus de 44 000 sujets (une moitié recevant le vaccin et l’autre moitié un placebo) et totalisant 468 cas symptomatiques de COVID-19. Cet essai a été mené aux USA, en Afrique du Sud et dans des pays d’Amérique Latine. Après 2 semaines, on observe une réduction globale de 67% des cas symptomatiques de COVID-19. L’efficacité du vaccin atteint 86% pour les formes graves et la protection serait complète vis-à-vis des hospitalisations et des décès (données non encore publiées et donc à confirmer). Ces résultats sont moins bons que ceux obtenus avec les vaccins Pfizer et Moderna mais restent bien supérieurs aux exigences de l’OMS (efficacité > 50%).
Des effets secondaires légers ou modérés.
La plupart d’entre eux (douleurs au site d’injection, maux de tête, fatigue, douleurs musculaires et nausées) surviennent dans les 48h suivant l’injection et disparaissent en 2 jours. Une fièvre modérée et transitoire est également observée chez 9% des individus. La sécurité du vaccin tout comme son efficacité continueront d’être évaluées pendant 2 ans dans cet essai.
Des interrogations communes à tous les vaccins.
Les données actuelles n’autorisent que des conclusions sur les effets à court-terme. La durée de la protection n’est pas connue et l’impact des mutations du SARS-Cov-2 reste incertain. De même l’efficacité et la sécurité du vaccin n’ont pas été évaluées chez les enfants et les femmes enceintes. L’impact de la vaccination sur la transmission virale reste également hypothétique.
Quel avenir?
L’Union européenne qui a connu un déploiement bien timide de la vaccination dispose d’un outil supplémentaire pour lutter contre la pandémie. La Commission européenne a précommandé 200 millions de doses d’ici la fin de l’année, dont 15 millions pour la France (livraison prévue fin mai). Ce premier vaccin dose unique arrive dans un contexte particulièrement problématique puisque plusieurs pays européens (Danemark, Islande, Norvège,..) ont annoncé ce même jour la suspension temporaire de l’utilisation du vaccin AstraZénéca en raison de thromboses veineuses survenues au décours de l’injection. S’il est peu probable qu’une inférence causale puisse être établie, ce nouvel épisode risque fort d’entretenir une forte réticence vis-à-vis du vaccin AstraZénéca et de compliquer encore les programmes vaccinaux.